Manifesto Fattoria Erba A Need Azoto Belle Mucca 1956
POSTER ORIGINALE autentico certificato
nessuna copia - nessuna riproduzione
NESSUNA COPIA certificata
COPERTO da noi
( SU LINO - RETRO LINO nel nostro studio )
118 cm x 80 cm
(+ 4 cm di margine di copertura, ideale per incorniciare)
(+ margine di supporto in lino di 4 cm, per incorniciare)
POSTER ORIGINALE
puoi contattarci per salvare i tuoi poster
copertura di restauro
LABORATORIO DI VECCHI MANIFESTI
posterstudio-france.com
(esempi fotografici delle nostre lavorazioni e preventivi su richiesta)-
Azoto
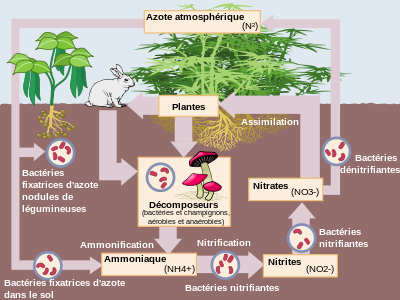
L'azoto è ilelemento chimico Di numero atomico 7, di simbolo N (da latino azoto). È il leader del gruppo musicale delle pnictogeni. Nel linguaggio comune si parla di azoto corpo semplice NON2 (diazoto), componente di maggioranza delatmosfera terrestre, che rappresentano quasi il 4/5e aria (78,06%, in volumeha). L'azoto è il 34e elemento costitutivo del la crosta terrestre in ordine di importanza.
IL minerali contenenti azoto sono essenzialmente i nitrati, in particolare il nitrato di potassio KNO3 (costituente di salnitro) O nitro, che servì fino alla fine del xixe secolo, per fabbricare polveri esplosive (i polvere nera), e il nitrato di sodio NaNO3 (costituente del salnitro cileno).
L'azoto ha molti usi industriali. È ampiamente utilizzato in particolare come fertilizzante agricoltura industriale (sotto forma di composti diammonio), al punto che oggi ne è il principale utilizzo nel mondo[rif. desiderato], un uso responsabile di un diffuso inquinamento ambientale[rif. necessario].
Storia
Nomenclatura e origine
Antonio Lavoisier ha scelto il nome azoto, composto da ha- (privativo) e il radicale greco ζωτ- (“vivente”) e che significa quindi “privo di vita”, perché a differenza delossigeno non sostiene la vita degli animali6.
L'origine del simbolo N è il suo nome latino azoto da cui proviene greco generatore di nitrone, che significa “allenatore di salnitro » (nitrato Di potassio). Il termine inglese azoto mantenne questa radice per designare l'azoto, mentre oggi il termine francese “nitrogène” non è più utilizzato.
Cronologia
Sebbene i composti contenenti l'elemento chimico azoto fossero noti fin dall'antichità (ad esempio il salnitro, cioè i nitrati di sodio e di potassio), il diazoto non venne isolato mediante Daniele Rutherford quello dentro 1772e indipendentemente da Carl Wilhelm Scheele E Henry Cavendish.
IL ossido nitroso NON2O è stato preparato da Giuseppe Priestley nel 1772.
L'ammoniaca NH3 fu preparato nel 1774, sempre da J. Priestley.
Il primo composto accettore-donatore che coinvolge l'azoto, H3N.BF3 è stato preparato nel 1809 da Louis Joseph Gay-Lussac.
Il primo composto che mostra un legame azoto-alogeno, tricloruro di azoto NCl3 è stato preparato da Pierre Louis Dulong che perse un occhio e la punta di un dito7,8 studiando le proprietà di questo corpo molto instabile e violentemente esplosivo.
Isotopi
L'azoto ne ha 16 isotopi conosciuto per numero di Massa variabile da 10 a 25, nonché a isomero nucleare, 11mN. Due di essi sono stabili e presenti in natura, l'azoto 14 (14N) e ilazoto 15 (15N), il primo rappresentando la quasi totalità dell'azoto presente (99,64%). All'azoto viene assegnata una massa atomica standard di 14,0067 tu. Tutti i radioisotopi dell’azoto hanno vita breve,azoto 13 (13N) con l'emivita più lunga, 9,965 minuti, mentre tutti gli altri hanno un'emivita inferiore a 7,15 secondi e la maggior parte inferiore a 625 ms.
Entità contenenti l'elemento chimico azoto
L'elemento chimico azoto è presente in entità contenenti solo l'elemento chimico N e in composti azotati, in modo diverso gradi di ossidazione.
Entità contenenti solo l'elemento chimico N
Esistono diverse entità chimiche contenenti solo l'elemento chimico azoto, la molecola di diazoto, l'atomo e due ioni di azoto.
Azoto
IL diazoto NON2 è la forma più comune di entità contenente solo l'elemento chimico azoto. Il triplo legame che collega i due atomi è uno dei legami chimici più forti (insieme al monossido di carbonio CO). Di conseguenza, il diazoto è cineticamente inerte. È la componente più abbondante dell'atmosfera terrestre. Industrialmente, il diazoto si ottiene per distillazione dell'aria ambiente.
La sua reattività principale è la formazione di ammoniaca Processo Haber
- NON2(g) + 3 ore2(g) → 2NH3(g)
L'atomo
Può essere ottenuto in laboratorio dal diazoto a bassa pressione (0,1 - 2 mmHg) in presenza di una scarica elettrica. La sua formazione è seguita per diversi minuti da un bagliore giallo pallido. Ciò risulta dalla diseccitazione di N2* in seguito alla ricombinazione di due atomi di N. Questa forma eccitata di diazoto può essere dimostrata in presenza di CO2. La CO e l'ossigeno atomico si formano quindi in uno stato di tripletto.
Ioni di azoto
Ci sono due ioni azoto stabile:
- Leone nitruro NON3− che esiste solo nei solidi (nitruri metallici) o in complesso metallico.
- Leone azide NON3−, forma base diacido azoidrico H.N.3 ; Può formarli entrambi sali come inorganicosodio azide NaN3 soltanto composti organici sostituito come il zidovudina in cui generalmente si comporta come a pseudoalogenuro.
Composti dell'azoto
L'azoto forma composti con molti altri elementi chimici. È presente ne composti organici e inorganico.
Azoto e idrogeno
Il composto principale con uno dei legami chimici NH èammoniaca NH3. Anche altri composti contengono questo legame:
- IL ioni ammonio NH4+
- ioni ammide NH2−
- IL ammine NHR primario2 e secondari R2NH
- l'acido azoidrico H.N.3
- l'idrazina NON2H4
- e una vasta famiglia di composti meno comuni, il azani e il azeni, come il trans-diazene NON2H2 e il suo isomero IL 1,1-diazene, IL triazene NON3H3, IL triazan NON3H5, eccetera.
Azoto e ossigeno
Ossido d'azoto
Ossidi di azoto conosciuti9 sono, aumentando il numero di ossidazione (medio):
- nitrosil azide N4O, scoperto nel 1993;
- protossido di azoto N2O, comunemente chiamato ossido nitroso ;
- IL monossido di azoto NO;
- IL triossido di diazoto NON2O3,
- e il trinitramide N(NO2)3 ;
- IL diossido di azoto NO2,
- e il suo dimero IL tetraossido di diazoto NON2O4 ;
- IL pentossido di diazoto NON2O5.
Tutti sono termodinamicamente instabili per quanto riguarda la decomposizione in NON2 E O2 a temperatura ambiente.
Ossanioni di azoto
I principali ossoanione° di azoto, stabili in mezzo acquoso, sono gli ioni nitrato NO3− e nitrito NO2−. Lo ione nitrato è la base coniugata di un acido forte,acido nitrico. Lo ione nitrito è la base coniugata di un acido debole, l'acido nitroso. Quest'ultimo è instabile e, in acqua, lo è "dismutato" in monossido di azoto (che si riossida in biossido di azoto in presenza di aria) e in ione nitrato.
Azoto e alogeno
Il più stabile degli alogenuri di azoto, NF3 è stato preparato solo in 1928, più di un secolo dopo l'instabile tricloruro NCl3. IL tribromuro di azoto NBr3, molto esplosivo, fu isolato solo nel 1975. Triioduro NESSUNO DEI DUE3 non è mai stato isolato, ma il suo addotto IO3N.NH3, un solido nero altamente instabile agli urti e alla temperatura, fu preparato nel 1812. Combinazioni come NON2F2 e ne esistono anche molti altri.
Azoto e metalli
Esistono molte azidi metalliche. Sono possibili diversi percorsi di sintesi:
La reazione tra il metallo e il diazoto caldo
- 3Ca+N2 → Quello3NON2
La reazione tra metallo e ammoniaca ad alta temperatura
- 3Mg + 2NH3 →Mg3NON2 + 3 ore2
Decomposizione delle ammidi
- 3Zn(NH2)2 →Zn3NON2 +3NH3
Reazioni di trasferimento
- Al2O2 +3C+N2 → 2AlN + 3CO
- 2ZrCl4 + 4 ore2 +N2 → 2ZrN + 8HCl
Funzionamento e usi
Diazoto
Oggi, gas azoto o diazoto è generalmente ottenuto per liquefazione diaria, di cui è il costituente principale con una concentrazione del 78,06% in volume e del 75,5% in massaha. La produzione globale è di circa 150 milioni di tonnellate all’anno.
Lo stesso gas di azoto ha in particolare le seguenti applicazioni:
- Confezione dei prodotti alimentari (CARTA GEOGRAFICA): L'inertizzazione degli alimenti confezionati ne aumenta la durata di conservazione sostituendo l'aria ambiente (contenente ossigeno) con azoto (purezza dal 95 al 99,5%)10* gas "neutro" utilizzato per proteggere (grazie alla costituzione dell’a atmosfera inerte confinati) di prodotti, oggetti o contenitori (serbatoi ad esempio) nell'industria, nei musei o in altri luoghi: protezione contro la corrosione, gli insetti, i funghi, ecc.
- In biologia, l'azoto liquido viene utilizzato come mezzo per congelare le cellule e per macinare manualmente i tessuti durante l'estrazione del DNA o delle proteine.
- Gas utilizzato come pesticida delicato per eliminare i tarli o alcuni organismi mediante asfissia (es: Piccola vrillette) aver colonizzato oggetti antichi fragili (cornici, sculture e oggetti lignei, incunaboli, pergamene, incisioni, ecc.);
- Inflazione del gas pneumatici. Sebbene l'aria contenga già il 78% di azoto (da diazoto per essere più precisi), alcuni professionisti delaviazione o il Formula 1 (ad esempio), aumentare questa proporzione e gonfiare i pneumatici con azoto quasi puro. Questo gas ha la proprietà di essere inerte e stabile conserva un pressione più costante anche in caso di riscaldamento intenso del pneumatico[rif. necessario]. Esiste anche una controversia riguardo all'introduzione di questo metodo per veicoli privati. Questi, infatti, sono sottoposti a molto meno stress, il che rende meno avvertibile la differenza con l’aria. D'altro canto, l'inflazione diventa tassabile e viene spesso criticata per il suo prezzo ingiustificato (l'inflazione aerea è spesso gratuita e considerata soddisfacente). Chi lo utilizza dovrebbe, in linea di principio, regolare l’inflazione più raramente, ma dovrebbe comunque controllare regolarmente la pressione.
- Gas utile per il gonfiaggio accumulatori idraulici a causa della sua passività nei confronti degli oli.
- Costruzione meccanica: molte moderne macchine da taglio funzionano con un raggio laser, questo richiede azoto come gas motore o come gas inerte10.
- Agente antincendio: legato al 50%.Argon e talvolta con diossido di carbonio, è presente in alcuni impianti automatici di estinzione del gas proteggere sale computer o aree di stoccaggio specifiche che non devono essere danneggiate da polvere o acqua. Conservato in bombole metalliche ad una pressione di circa 200 bar, viene rilasciato in un locale dove si avvia un processo difuoco è stato rilevato. Il volume di azoto iniettato sostituisce parte dell'atmosfera nella stanza e provoca una diminuzione del livello di ossigeno nell'aria. Il livello generalmente accettato del 15%. ossidante interrompe il fenomeno di combustione Senza effetto letale sulla respirazione umana.
- Metallurgia: l'azoto viene regolarmente iniettato nei forni per la produzione di metalli altamente ossidabili (es. alluminio e sue leghe) per impedirne la reazione con l'ossigeno presente nell'aria. Viene utilizzato anche per prevenire la corrosione durante la saldatura (es. saldatura in rame)10.
- Azoto liquido: agente refrigerante.
Diazoto, a differenza dei gas inibitori chimici alogenati e CFC non presenta a priori nessun effetto dannoso per l'ambiente (nessun impatto suleffetto serra, né sul strato di ozono). Ma occorrono serbatoi di grandi dimensioni, tubazioni adeguate e accorgimenti costruttivi per far fronte all'improvvisa espansione di un equivalente pari al 40-50% del volume protetto.
Pericolo gas di azoto: l'utilizzo di diazoto per creare atmosfere confinate inerti è causa di diverse morti per asfissia, quando una persona entra in un recinto inerte senza rendersene conto; È necessario verificare la presenza di una quantità sufficiente di ossigeno in tali spazi confinati prima di accedervi, oppure munirsi di un autorespiratore.
Durante l'immersione, l'azoto contenuto nell'aria respirata sotto pressione è all'origine del fenomeno della narcosi. È percepibile a partire da una PpN2 = 3,2 bar (ovvero 30 metri per un'immersione con aria a livello del mare) per le persone più sensibili e più comunemente nella zona tra 40 e 60 metri. Diventa “tossico” per l’organismo a partire da una PpN2 = 5,6 bar (ovvero 60m per un’immersione con aria a livello del mare)11. Questo è il motivo per cui in Francia le immersioni subacquee sono limitate a 60 metri.12.
L'azoto è anche l'unico elemento che ne determina la durata e la profondità fermate di decompressione di un'immersione in aria.
Utilizzo di composti azotati
Paradossalmente, e nonostante il nome, l’elemento chimico “azoto” è (con l’ carbonio, l'ossigeno e ilidrogeno) uno dei componenti principali della vita e ecosistemi così come agrosistemi. Entra nella composizione di proteine (per circa il 15%). L'azoto è presente in molte sostanze chimiche, alcune delle quali pesticidi detto a “uree sostituite”.
L'azoto è stato ed è tuttora sfruttato comefertilizzante naturale nelurea animale (o umano) e guano (escrementi secchi diuccello O pipistrello), in particolare in Chile, A Perù, In India, In Bolivia, In Spagna, In Italia e dentro Russia. Una volta il nitro (nitrato minerale naturale) veniva raccolto per la produzione polvere da sparo.
Oggi i suoi composti sono prodotti principalmente industrialmente da sintesi chimica per molti usi, tra cui:
- fertilizzanti agricoli (fertilizzante) ; i sali di ammonio vengono assorbiti dalle piante, che sono quindi costrette ad assorbire più acqua (equilibrio osmotico). Questi sali costringono così la pianta a crescere. Se altri minerali sono presenti in quantità sufficiente (fosforo, potassio in particolare) questo azoto favorisce la crescita delle piante coltivate. L'azoto viene per questo motivo utilizzato sotto forma di nitrato Diammonio, N.H.4NO3, Di solfato d'ammonio, (N.H4)2COSÌ4, Di monofosfato di ammonio, N.H.4H2P.O.4, o urea, CO(NH2)2. È oggi il principale utilizzo dell’azoto nel mondo, responsabile anche di un diffuso inquinamento (eutrofizzazione, distrofica) dell'ambiente (acque falde, estuari, alcune coste, dall'aspetto vasto zone morte negli oceani considerati di grande preoccupazione dalONU)[rif. necessario].
- prodotti farmaceutici :
- alcuni composti biologicos nitrato, come nitroglicerina, sono usati per trattare alcune condizioni cardiovascolari;
- IL ossido nitroso (gas esilarante) è usato come anestetico ;
- l'ammoniaca NH3, utilizzato come materia prima per la produzione di polimeri, esplosivi, fertilizzanti o come refrigerante in alcuni impianti industriali;
- combustibili (lidrazina e altri derivati come carburanti per missili);
- esplosivi (composti chimici organici che hanno più gruppi -ONO2 o no2 : dinamite) ;
- gas propellenti per bombe aerosol (NON2O) o aerografi;
- conservatore (nitrato di sodio, NaNO2, sotto il numero E E250);
- sodio azide, utilizzato per gonfiare istantaneamente il airbag di sicurezza (di un'auto, ad esempio) in caso di urto.
Bilancio dell'azoto
La principale fonte di azoto alimentare si trova in aminoacidi. Infatti gli unici organismi in grado di utilizzare l’azoto atmosferico sono i batteri. Il bilancio dell’azoto è l’unico modo conosciuto per misurare l’azoto in modo non invasivo[rif. necessario]. In geologia, ad esempio, irradiamo le pietre per quantificare il contenuto atomico di alcuni elementi come l'azoto. Questo non è riproducibile negli esseri umani per ragioni etiche.
Il bilancio dell'azoto viene dedotto in base agli apporti e alle perdite di azoto.
In pratica, il bilancio azotato viene stimato in base all’escrezione urinaria di urea utilizzando due formule:
| Impression | Couleur |
| Epoque | Rétro (1900-1979) |
| Dimensions | 118 X 80 CM |
| Pays de fabrication | France |
| Thème | AFFICHE ANCIENNE |
| Objet modifié | Non |